
5 3 Volledig en onvolledige verbranding YouTube
Volledige en Onvolledige verbranding, - YouTube. 0:00 / 3:48. Volledige en Onvolledige verbranding, Annelies van de Vuurst. 29 subscribers. Subscribe. 221. 16K views 6 years ago Klas 4,.
Wat is het verschil tussen volledige en onvolledige verbranding?
Bij een onvolledige verbranding komt minder energie in de vorm van warmte vrij dan bij een volledige verbranding. Giftigheid en milieubelasting van verbrandingsproducten. Als bekend is uit welke atomen een molecuul van een brandstof bestaat, kan de kans op het vrijkomen van giftige verbrandingsproducten worden voorspeld.

Volledige en onvolledige verbranding YouTube
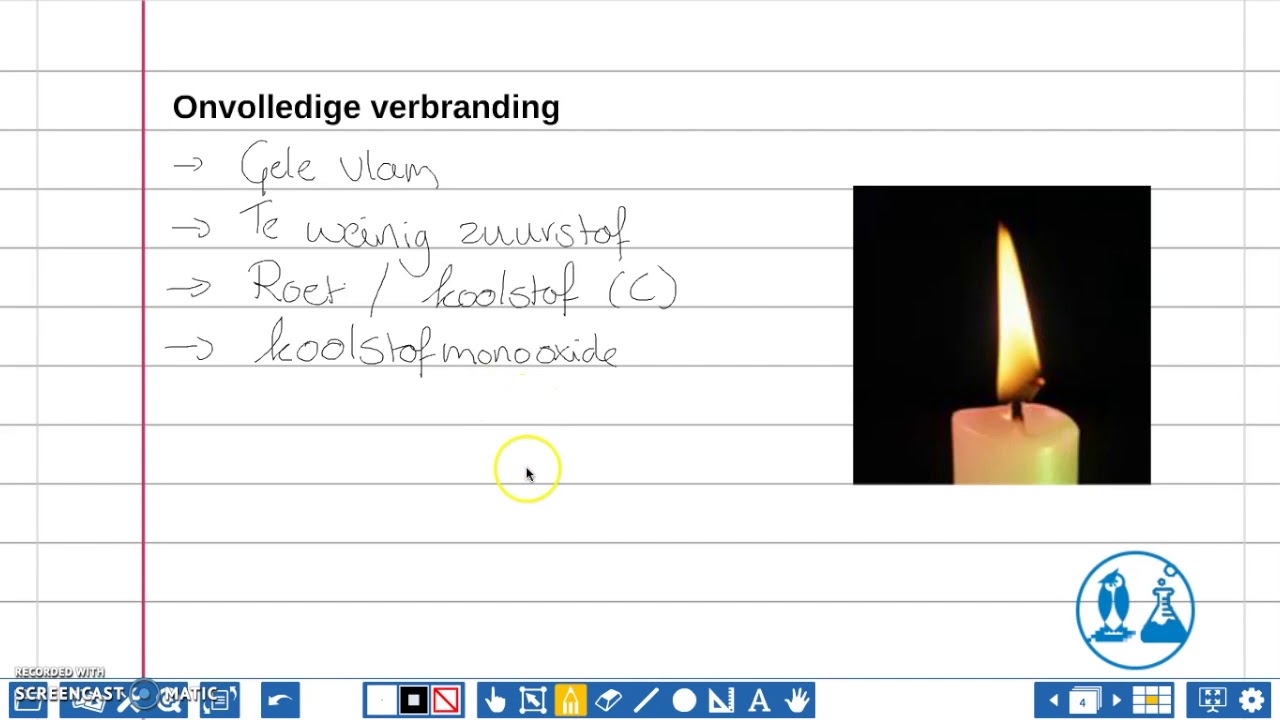
volledige verbranding 1.0. verbranding waarbij de brandstof zich verbindt met zoveel van de oxidator als mogelijk is en waarbij minder schadelijke reststoffen overblijven, zoals roet, koolstofmonoxide, koolstofdioxide en stikstofoxiden. Volledige verbranding is schoner dan onvolledige verbranding.

Brandstoffen en Warmte
Bij onvolledige verbranding is er te weinig zuurstof om verbinding aan te gaan met alle brandstof. Volledige verbranding van een stof houdt in dat de stof zich verbindt met zoveel van de oxidator (meestal zuurstof) als mogelijk is.

PPT 3.2 Volledige en onvolledige verbranding PowerPoint Presentation ID3871267
Een verbranding kan volledig of onvolledig zijn. Het is een natuurverschijnsel dat al begonnen is sinds de aarde is geboren. Vlammen. Bij een brand zie je vlammen. Alle vlammen samen vormen het vuur. Verbranden is een chemisch proces waarbij veel warmte vrijkomt. Als een vaste stof verbrand dan ontstaan er brandbare gassen.

Onvolledige verbranding en reactievergelijkingen YouTube
Bij onvolledige verbranding is er niet voldoende zuurstof om alles tot water en koolzuurgas te verbranden en ontstaan diverse tussenproducten en zuurstofarme restproducten als koolmonoxide en koolstof. Bij een onvolledige verbranding van etheen zou bijvoorbeeld het volgende kunnen gebeuren: C 2 H 6 + O 2 -> CH 4 + CO + H 2 O.

PPT 3.2 Volledige en onvolledige verbranding PowerPoint Presentation ID3871267
In deze video leer je over de volledige en onvolledige verbranding van koolwaterstoffen. Je leert welke reactieproducten er ontstaan en hoe je een volledige en onvolledige verbranding kunt.

Volledige en onvolledige verbranding YouTube
Vraag: wat is het verschil tussen een volledige en een onvolledige verbranding? Havo vwo scheikunde.

PPT 3.2 Volledige en onvolledige verbranding PowerPoint Presentation ID3871267
§3.4 Volledige en onvolledige verbrandingen. §3.5 Brandstoffen en milieuvervuiling. §3.6 Reactiesnelheid. Slide 1 - Tekstslide. Leerdoelen. Na deze ken jij de verschillen tussen een volledige- en onvolledige verbranding. Na deze les weet jij wat een reagens is. Je weet wat je met helder kalkwater aantoont en wat je hierbij waarneemt.

Uitleg volledige en onvolledige verbranding 2 YouTube
Pieter Soeteman. 7,2. 135. Uitlegvideo over de vraag: wat is het verschil tussen een volledige en een onvolledige verbranding? Scheikunde. scheikunde. Onvolledige verbranding. Volledige verbranding. Onbeperkt video's bekijken? Registreer je bij Scholieren.com en krijg onbeperkt toegang tot alle video's. Registreer je gratis!

PPT 3.2 Volledige en onvolledige verbranding PowerPoint Presentation ID3871267
Bij onvolledige verbranding (dus hoge CO-gehalte) is er een grotere waterstofontwikkeling, hierdoor koelt de weerstand sterk af. Bij volledige verbranding (lage CO-gehalte) is er meer ontwikkeling van kooldioxide en waterdamp, waardoor de weerstand minder afgekoeld wordt.

Volledige en Onvolledige verbranding, YouTube
Volledige en onvolledige verbranding. Aantonen water en koolstofdioxide. Opgaven volledige en onvolledige verbranding. Broeikaseffect en zure regen. zure regen. Opgaven broeikaseffect en zure regen. Bijzondere verbrandingen. 8 stellingen over verbranding. Opdracht. Onderzoeksvraag opstellen. Oefenen voor de toets. Antwoorden opgaven. Colofon.
Volledige en onvolledige verbranding/ De brander StudyGo
Volledige verbranding versus onvolledige verbranding. Volledige verbranding en onvolledige verbranding verschillen in de hoeveelheid beschikbare zuurstof. Als de hoeveelheid voldoende of meer is, is er sprake van een volledige verbrandingsreactie; als het minder is, is het een onvolledige verbrandingsreactie.

Wat is het verschil tussen volledige en onvolledige verbranding?
Volledige verbranding. Volledige verbranding van een stof betekent dat de brandstof helemaal aan de zuurstof bindt. Als een stof volledig verbrandt, dan betekent dit dat er genoeg zuurstof-deeltjes zijn om met de brandstof te reageren. Er ontstaan dan geen afvalproducten.

PPT 3.2 Volledige en onvolledige verbranding PowerPoint Presentation ID3871267
Bij volledige verbranding van organische stoffen reageert koolstof met zuurstof tot kooldioxide (CO 2) en water (H 2 O): CH4 + 2 O 2→ CO 2 + 2 H 2 O. Bij een tekort aan zuurstof is de verbranding onvolledig. Er ontstaat dan minder kooldioxide en in plaats daarvan ontstaat koolmonoxide. De reactievergelijking voor aardgas is dan:
3H Volledige en onvolledige verbranding YouTube
Verbranding, volledig en onvolledig. Ook in de koolstofchemie komen redoxreacties voor. Veel koolstofverbindingen zijn in staat om elektronen af te staan of op te nemen. Let wel: als er hier over oxidatie wordt gesproken, dan wordt niet bedoeld de directe verbranding met zuurstof.